实验笔记丨病毒感染细胞实验的步骤详解(下卷)
共转染 293T 细胞产生病毒(病毒包装)
4.1 名词解释
4.1.1 293T 细胞是由 293 细胞派生, 表达 SV40 大 T 抗原的人肾上皮细胞系, 被广泛应用于瞬时转染以过表达各种目标蛋白, 或是用以包装病毒。
4.1.2 脂质体:某些细胞质中的天然脂质小体,可作为生物膜,用于捕获外源性物质后更有效地运送到靶细胞,经同细胞融合而释放。
4.2 共转染的操作步骤
第一天:
用无抗生素 DMEM+10%FBS 铺板 293FT 细胞,2ml/孔。确保第二天细胞密度达到 80%-90%融合度。
第二天:
1. 500ul 无血清培养基稀释 2ug 表达质粒+1.5ug psPAX2+1.5ug pMD2.G。
2. 500ul 无血清培养基稀释 15ul 脂质体 2000。
3. 5min 后,将 DNA 溶液和脂质体溶液混合,室温静止 20min。
4. 从 6 孔板中吸出 1ml 无血清培养基,然后滴加入 1ml 质粒和脂质体混合物。
5. 6-10h 后,移除含有 DNA-脂质体复合物的培养基,代之以正常培养液 DMED+10%FB(从此刻开始算时间)。
第三天:
转染 24h 后,荧光显微镜下观察,转染效率应达到 70%以上。
第四天:
1. 转染后 48 和 72h 分别收获含病毒的上清。
2. 3000 rpm 离心 20min,0.45um 滤膜过滤,去除细胞沉淀。
3. 12000 转离心浓缩细胞、分装-80°C 贮存。
4. 滴度测定目的基因检定,并出具检测报告。
4.3 病毒包装的原理
质粒 DNA 为能转录出慢病毒遗传物质(RNA),但不能翻译出慢病毒的外壳及蛋白成分的载体质粒,其同时连有目的基因和报告基因,psPAX2 为能表达慢病毒外壳的质粒,其表达产物可通过粘附机制更易穿过细胞膜, pMD2.G 为慢病毒的膜蛋白质粒,通过lipofectamine2000 进行三质粒共转到靶细胞基因组中,宿主基因组在表达时,随宿主基因转录出的目的基因 RNA 与 psPAX2、pMD2.G 基因翻译出的蛋白组装为慢病毒。
在上述程序中提及的“第四天”收集病毒。在第五天再用该病毒感染靶细胞,病毒进入细胞后,其遗传物质 RNA 反转录出 DNA,该基因再整合到靶细胞的基因组中,完成转染过程,因为质粒 DNA 只能转录出病毒 RNA 和表达目的基因却不能表达出病毒的外壳和膜蛋白成分,因此其不能像普通的病毒一样在宿主细胞能反复增殖,故对宿主细胞是无害的并且高效的将目的基因转然到靶细胞基因组中。
慢病毒感染细胞
5.1 流程图
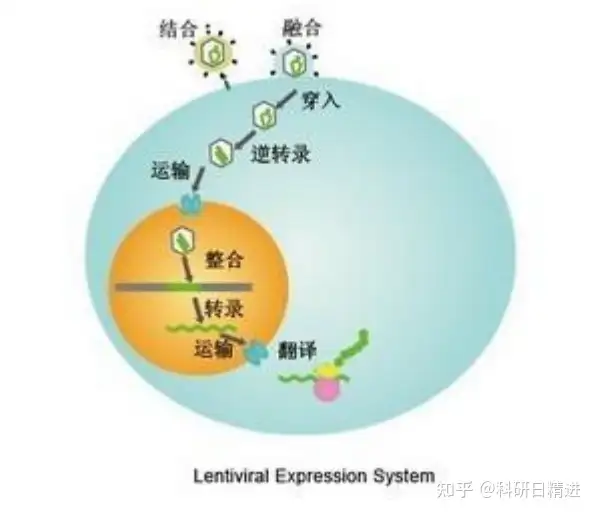
5.2 感染步骤
1)铺板:将对数生长期的细胞消化重悬后,按 1*105/L 密度接种于 12 孔板,生长过夜。
2)感染:将 70-80%铺满 12 孔板中的培养液吸除,换新鲜的培养液,同时加入 PBS 浓度梯度稀释的病毒液,混合均匀后即可放入孵箱培养。
3) 24h 左右可换液,48 小时即可看荧光,具体根据细胞状态来看。
5.3 荧光显微镜的操作流程
打开荧光器(30min 内不能关闭,否则影响显微镜寿命),细胞培养板置于载物台,调节物镜和光圈,先用自然光观察视野内细胞,再关闭光,开启荧光通道,观察荧光强度,判定感染率。图片取样前可以调节曝光时间,增益值和彩色度使荧光照片最完美。(针对 leica)
5.4 注意事项内容
1. 病毒浓度要适宜,太少的话细胞被感染的也少,但是病毒浓度太大,对细胞有伤害。
2. 感染病毒时培养基量少,以保证病毒的浓度,在培养 10h 左右可根据培养基颜色加培养基。
3. 在不明确细胞感染复数情况下,可进行浓度梯度感染,计算细胞感染复数。
4. 在加病毒后一般 24h 左右可换液,48 小时即可看荧光,具体时间根据细胞状态来看。
感染后的细胞检测方法
6.1 荧光初步检测
若有荧光,则表示病毒感染成功,但并不能确定目的基因是否整合到细胞中,待进一步检测,荧光有强弱之分,与病毒加入的量有关。
6.2 RNA 的提取及 RT-PCR 检测
6.2.1 原理
因为真核细胞 DNA 含有很多非编码区,真核生物的 DNA 转录成为 RNA 之后,经过剪切和拼接,去掉这些非编码区,才能形成真正的 mRNA,,是否表达真核生物的基因并表达相应的蛋白,只能通过提取其 mRNA 并 RT-PCR 这条途径来测定。
6.2.2 RNA 提取步骤
加 1mlTrizol,吹打后移至 1.5ml 无菌的离心管中;加 100ul 氯仿剧烈振荡 30s 混匀,12000 转 15min,可看到明显分层;取上层透明液体至新的 1.5ml 离心管中,加等体积的异丙醇,混匀静置 10min,12000 转离心 10min,弃上清,加 1ml70%乙醇,12000 转,离心 10min,弃上清,风干剩余液体,最后加 DEPC-水溶解 RNA,电泳,粗步判定 RNA纯度。
6.2.3 RT-PCR 步骤
RT 是一个逆转录的过程,用前一天提取好的总 RNA,在加入引物,模版和酶,并在 PCR仪的温度设置下,RNA 可逆转录为 cDNA。PCR 是 cDNA 在模版,引物,酶的作用下进行复制成双链 DNA。(具体步骤省略)
6.3 蛋白提取及 Western 检测
western-Bloting:蛋白免疫印迹(Western blotting 或 Immunoblotting)一般由凝胶电泳、样品的印迹和免疫学检测三个部分组成。第一步是做 SDS 聚丙烯酰胺凝胶电泳,使待测样品中的蛋白质按分子量大小在凝胶中分成带。第二步把凝胶中已分成条带的蛋白质转移到一种固相支持物上, 用得最多的材料是硝酸纤维素膜(NC 膜)和 PVDF 膜, 蛋白转移的方法多用电泳转移 (转移电泳) ,它又有半干法和湿法之分,现在大多用湿法。第三步是用特异性的抗体检测出已经印迹在膜上的所要研究的相应抗原。免疫检测的方法可以是直接的和间接的。现在多用间接免疫酶标的方法,在用特异性的第一抗体杂交结合后,再用酶标的第二抗体(碱性磷酸酶(AP)或辣根过氧化物酶(HRP)标记的抗第一抗体的抗体)杂交结合,再加酶的底物显色或者通过膜上的颜色或 X 光底片上暴光的条带来显示抗原的存在。该技术被广泛应用于蛋白表达水平的检测中。
其他实验技能分享:
实验笔记丨B 淋巴细胞分离技术
实验笔记丨SSR 分子标记实验的步骤详解和注意事项
实验笔记丨Southern Blot 步骤详解和注意事项
不能更详细!染色质免疫共沉淀(ChIP)实验方法
实验笔记丨Far western blotting实验步骤和重点考虑因素
科研日精进:实验笔记丨分子间相互作用分析——微量热泳动(MST)技术介绍
科研日精进:实验笔记丨双荧光素酶报告基因验证法
科研日精进:Western Blotting实验中常见问题及解决方案
科研日精进:Western Blotting技术之免疫检测
更多科研实验干货,请关注“科研日精进”VX公众号
本站所有文章、数据、图片均来自互联网,一切版权均归源网站或源作者所有。
如果侵犯了你的权益请来信告知我们删除。邮箱:dacesmiling@qq.com






