百济神州是怎么做生意的?

撰文|王志 编辑|LZ
定位为“植根中国,放眼全球”的百济神州,依托自主研发、授权许可及合作研发构成自身产品逻辑。
通过建立内部关键能力,在全球进行临床开发和运营,且在中国和美国全球两个最大医药市场建立商业化平台,并以此获得收入。
产品逻辑之自主研发及全球商业化
百济神州拥有完整肿瘤生物学自有研发体系,建立了包括药物化学、发现生物学、生物药和转换科学在内的临床前研究部门。
在小分子、抗体类药物研发及新药物的生产等方面,建立了13个核心技术平台。
通过分析化学研究平台、化合物筛选平台、小分子激酶抑制剂优化平台和双(多)特异性抗体发现平台、单B细胞抗体筛选平台、噬菌体展示文库筛选双特异性抗体技术平台、抗体-药物偶联物(ADC)开发平台、 蛋白水解靶向嵌合分子技术平台,公司得以发现并筛选新的靶点、抗体,找出最佳候选药物。
通过工艺化学研究平台、制剂工艺研究平台、生物药化学成分生产和控制(CMC)开发平台、生物药理化特性及功能表征分析平台、适合于单抗药表达平台和上游生产的化学成分确定的(CD)培养基研究,公司得以对候选药物的理化性质、结构表征、生物学功能表征进行分析,并对药物的生产工艺进行开发。

在研发成果转化方面,公司建立了病理检测平台、数字病理图像分析平台、生物信息数据整合分析可视化平台和单细胞免疫图谱分析平台等4个核心技术平台。
依托上述平台,百济神州自主研发的百悦泽®、百泽安®和百汇泽®3款抗肿瘤产品已相继上市,另有8款自主产品处于早期临床阶段。
核心单品百泽安®2020年开始贡献收入,在前三个季度实现销售收入6.98亿元占比营收47.83%。
这仅是百泽安®商业化的开始。百济神州2021年与诺华达成全球战略合作,授权诺华在北美、日本、欧盟及其他6个欧洲国家开发、生产和商业化抗PD-1单抗替雷利珠单抗。
双方将在上述国家对替雷利珠单抗进行共同开发,诺华将在过渡期后负责注册申请,并在获得批准后开展商业化活动。
公司可在北美地区共同进行产品销售,其中部分运营资金将由诺华提供。
双方将保留其自主研发产品联合替雷利珠单抗用药组合的全球商业化权利。
根据协议,公司获得6.5亿美元首付款,达到注册里程碑事件后还将获得至多13亿美的付款,且在达到销售里程碑事件后获得至多2.5亿美元付款,另有资格获得替雷利珠单抗在授权地区未来销售的特许使用费。
与诺华的合作也是迄今为止中国药物授权交易首付款和交易总金额最高的合作。
产品逻辑之授权许可“引进来”
在授权诺华之前,百济神州2017年就与新基关于百泽安®的开发及商业化订立战略合作。
不过这一合作在2019年6月终止,新基就合作终止向公司支付1.5亿美元。2017年-2019年公司对新基技术授权和研发服务收入为14.39亿元、4.35亿元、14.18亿元。
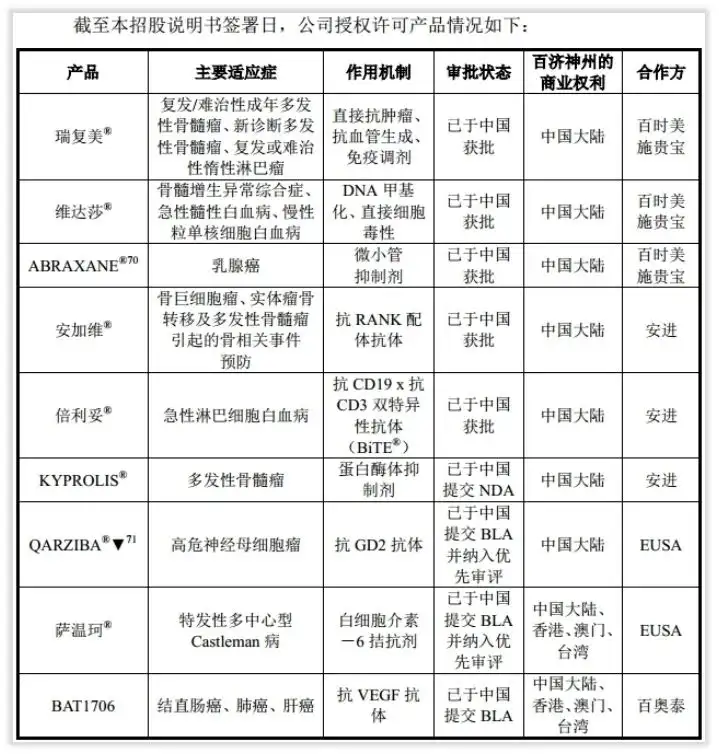
除了上述合作外,百济神州还接手了新基在中国商业化团队的运营,拥有后者在中国获批产品的独家授权,包括瑞复美®、维达莎®及ABRAXANE®。
与新基合作打开了以授权许可方式将产品“引进来”的路子。
公司2019年与安进订立合作协议,将负责安进抗肿瘤产品安加维®、倍利妥®及 KYPROLIS®在中国大陆获批后5年或7年的商业化权利。
其中,安加维®已在2020年实现商业化上市。
双方按50:50原则平分各产品利润并承担相应损失。
商业化期满后,百济神州有权保留1款产品在中国继续销售,并有资格在额外的5年内对未保留产品在中国的销售分级中取中单位数至低双位数的特许使用费。
已上市授权产品瑞复美®、维达莎®、ABRAXANE®及安加维®于2017年-2019年及2020年1-9月实现销售收入1.65亿元、8.65亿元、15.28亿元及5.98亿元,在营收中占比10.25%、66.03%、51.74%和41%。
授权许可引进产品在继续,百济神州2020年先后与EUSA Pharma和百奥泰订立协议。
获得前者孤儿生物制剂药物萨温珂®及QARZIBA®▼在中国大陆及港澳台地区的分销、许可和供应,后者授权公司在中国大陆及港澳台地区对BAT1706进行开发、生产及商业化。
在与EUSA合作中,公司在有关地区出资并进行所有临床开发及药证申报。EUSA已收取4000万美元的预付款,达到药政申报和商业里程碑后有资格获得最高合计1.6亿美元的付款,且还可获得未来产品销售的分级特许使用费。
在与百奥泰的合作中,除了向其支付2000万美元首付款外,达到注册及商业化里程碑后后者还可获得累计不超过1.45亿美元以及两位数百分比的销售提成。
产品逻辑之合作研发
公司与安进的合作远不止产品授权许可,两者还将在全球范围内针对实体瘤及血液瘤共同开发一系列安进抗肿瘤管线药物,包括小分子靶向药物以及双特异性T细胞结合抗体(BiTE®)免疫疗法相关的15个产品。
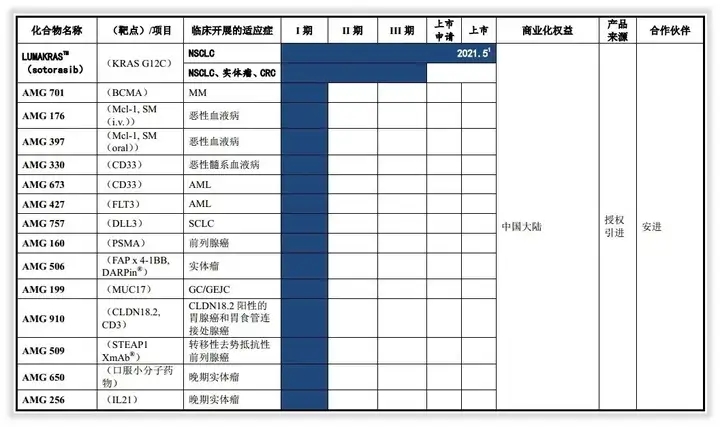
安进与公司共同承担在全球范围内的开发费用,其中公司将在合作期间贡献包括开发服务和现金在内总价值至多12.5亿美元,且公司有权获得除LUMAKRASTM(sotorasib)外的每款产品在中国以外全球销售的特许使用费。
每一款在中国获批的管线药物,公司将获得其批准后长达7年的商业化权利,期间双方将平分利润或亏损。7年商业化期满后,公司有权获得未保留管线药物5年在中国的特许使用费。
这一合作为迄今全球跨国药企与中国生物科技公司之间达成交易涉及金额最大、产品和管线药物最多的合作。
百济神州2018年还与Mirati就sitravatinib 在亚洲(不包括日本及若干其他国家)、澳大利亚及新西兰的开发、生产及商业化订立独家授权许可协议。
除获得1000万美元的预付现金外,Mirati还将获得高达1.23亿美元的潜在临床开发、注册和销售里程碑付款,以及在特许经营地区销售分红。
同年还与Zymeworks签署许可和合作协议,获得后者双特异性候选药物ZW25和ZW49在亚洲(日本除外)、澳大利亚和新西兰的独家开发和商业化权利。
Zymeworks获得4000万美元的授权许可首付款以及至多3.9亿美元的临床开发及商业化里程碑付款,还将获得在上述国家销售的分级特许使用费。
合作开发在2020年得到持续拓展。
百济神州获得Assembly授予ABI-H0731、ABI-H2158及ABI-H3733在中国(包括港澳台地区)独家开发和商业化的权利。
Assembly获得4000万美元现金预付款,并在授权候选药物开发和商业化取得成功后可获得至多约5亿美元的潜在开发、药政及净销售额里程碑付款,还有净销售额分级特许使用费。
公司2020年与丹序生物就其开发的新冠肺炎病毒中和抗体达成独家授权协议,后者授予公司对其临床前候选药物DXP-593、DXP-604以及其他抗新冠中和抗体在中国大陆及港澳台地区以外的全球范围内进行独家开发、生产及商业化权利。
它还与BioAtla就新型条件性激活生物制剂CTLA-4疗法达成全球开发和商业化合作,将拥有BA3017的全球独家授权,并全权负责其在全球范围内的临床开发和商业化,以及有权获得产品未来销售的全部利润。
此外,百济神州与Leap Therapeutics就DKN-01达成独家选择权和授权许可协议,与Seagen 就临床前候选药物SEA-CD70达成全球许可协议,与SpringWorks成立MapKure专注开发在研高选择性的新一代RAF激酶抑制剂BGB-3245。
产品逻辑之CMO+两大自主生产基地
生产方面,与CMO合作,与Catalent签订商业供应协议在美国生产百悦泽®,与勃林格殷格翰中国签订委托生产协议在上海生产百泽安®。
自主生产建设方面,百济神州已在苏州和广州分别建立了小分子及大分子生物药生产基地以支持产品开发及商业化。
按照美国、欧盟及中国监管规定的设计标准在苏州建立了多功能产业化基地,包括年产量约1亿片/粒的小分子药物生产基地及500升规模的中试生物制剂生产设施。
公司正在广州建设具有世界领先水平的大分子生物药生产基地,一期及二期工厂已分别于2019年9月和2020年12月落成,目前建成产能达2.4万升的生物制剂生产设施。
国家药监局2021年4月已批准一期工厂8000升产能用于公司为中国市场生产和供应百泽安®。
广州生产基地三期工厂计划产能为4万升,预计2020年底前建设完成,落成后总产能可达6.4万升。
未来,广州生产基地产能预计将超过12万升,最高可达20万升。
百济神州2019年营收29.54亿元,已超过此前两年之和,快速崛起。
注:文中图片来自《百济神州招股说明书》。
睿蓝财讯出品
文章仅供参考 市场有风险 投资需谨慎
来源:睿蓝财经(ID:ruilan808)
本站所有文章、数据、图片均来自互联网,一切版权均归源网站或源作者所有。
如果侵犯了你的权益请来信告知我们删除。邮箱:dacesmiling@qq.com
上一篇:百济神州(北京)生物科技有限公司
下一篇:百济神州争流史







