受试者保护势在必行(一)--伦理审查的范围及流程

专家介绍|王晶,博士,首都医科大学附属北京中医医院 医学伦理委员会秘书,北京同仁堂中医医院伦理委员会委员,中国医学伦理学-生物医学研究创新发展伦理建设委员会副主任委员,世界中医药学会联合会伦理审查委员会第三届理事会理事,中国中医药信息研究会青年医师分会伦理学组理事;入选国家卫生健康委全球卫生人才后备库,北京市医院管理中心第四批“青苗”计划(QML20181004),国家中医药管理局“中医药外向型优秀骨干人才”。多次进行伦理培训授课,2019年10月第四届健康医学(大)数据共享与合作高峰论坛(国家人口与健康科学数据共享服务平台临床医学科学数据中心(协和)和温州医学院公共卫生管理学院)进行大会报告(《中医药大数据研究伦理审查--要点与策略》);2019年11月亚太地区伦理审查委员会年会暨全体会员大会(亚太地区伦理审查委员会主办,马来西亚槟城理科大学(USM)承办)进行大会报告《Regional Ethics Committee of TCM Hospitals in Beijing(北京市属中医院区域伦理委员会)》等。
伦理审查视为科学研究保驾护航,而非设置障碍。作为承担涉及人的生物医学研究项目的主要研究者或课题组成员,在课题立项后、准备开展研究前,应该首先通过本机构伦理委员会审查并获得伦理委员会的书面同意后,方可在本机构开展临床研究。研究者作为临床研究的实施者,是保证临床研究质量及受试者安全和权益的关键。本文将就伦理审查的范围、依据、原则、流程等要点问题进行简要的介绍。
1、伦理审查范围
——注意要点:涉及人的生物医学研究必须在研究实施前,研究者应当获得伦理委员会的书面同意。
2016年10月,中华人民共和国国家卫生和计划生育委员会颁布的《涉及人的生物医学研究伦理审查办法(第11号)》中明确规定涉及人的生物医学研究包括:
新药科研器械:采用现代物理学、化学、生物学、中医药学和心理学等方法对人的生理、心理行为、病理现象、疾病病因和发病机制,以及疾病的预防、诊断、治疗和康复进行研究的活动;新技术:医学新技术或者医疗新产品在人体上进行试验研究的活动;病例研究、行为学研究:采用流行病学、社会学、心理学等方法收集、记录、使用、报告或者储存有关人的样本、医疗记录、行为等科学研究资料的活动。
2、伦理审查依据
医疗机构开展伦理审查是依据国内的各项法规及指南以及国际的伦理准则。主要包括:
_中华人民共和国国家卫生和计划生育委员会:《涉及人的生物医学研究伦理审查办法(第11号)》(2016年)_国家药品监督管理局、国家卫生健康委:《药物临床试验质量管理规范》(2020年)_国家食品药品监督管理局:《药物临床试验伦理审查工作指导原则》(2010年)_国家中医药管理局:《中医药临床研究伦理审查管理规范》(2010年)_世界医学大会:《赫尔辛基宣言》(2013年)_WHO:《生物医学研究审查伦理委员会操作指南》(2011年)_CIOMS:《涉及人类受试者的医学研究国际性伦理指南》(2016年)
扫码查看相关文件

3、伦理审查原则
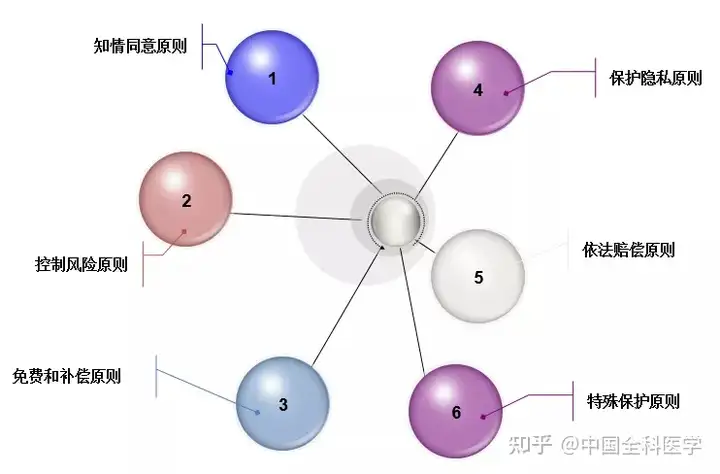
国家卫健委颁布的《涉及人的生物医学研究伦理审查办法(第11号)》(2016年)中明确指出涉及人的生物医学研究应当符合知情同意原则、控制风险原则、免费和补偿原则、保护隐私原则、依法赔偿原则,以及针对儿童、孕妇、智力低下者、精神障碍患者等特殊人群的受试者,应当予以特别保护的伦理原则。

4、伦理审查流程
伦理审查涉及临床研究科研工作的全过程,包括立项前的课题申报伦理审查、立项后的学术审查、伦理初始审查、各类型跟踪审查,以及一些未得到基金支持的研究者自发研究(IIT,Investigator Initiated Trials)。科研项目全流程管理是一个临床研究项目从标书撰写、申报前、立项后、进行过程中,以及暂停或是完成结题的全过程。在科研项目管理的各个关键时间截点中,科教管理部门承担着标书撰写过程中的科研方法学培训,课题申报前的院内培训,课题立项后的学术委员会审查,课题进行过程中的中期检查,以及项目完成后的总结报告审查和结题审查验收。在科研项目的全流程管理过程中,伦理审查在科研项目管理各个环节的审查关注点和具体把控环节。
课题申报前
申报项目的标书和知情同意书等材料,应该在伦理委员会审查后,得到伦理委员会同意该项目申报的意见后,进行申报。
课题立项后
伦理委员会对项目的审查。临床研究在获得伦理委员会批准后方可实施,伦理审查形式应与研究特点相称,既避免因低估风险而简化审查程序所导致的审查不充分,也避免因高估风险而延误研究推进。通常采取会议审查的方式,伦理委员会需要评估研究方案的科学性、伦理性;知情同意书、招募广告等受试者相关材料;评估研究的风险受益比;批准研究方案、知情同意书、招募材料等受试者项目材料的版本号、版本日期;确定批件有效期及定期跟踪频率。“伦理审查具体要点”伦理委员会批准研究项目的九条基本标准分别是:
⑴ 尊重受试者权利;
⑵ 研究方案科学;
⑶ 受试者选择合理、公平;
⑷ 风险与受益比合理;
⑸ 知情同意书规范;
⑹ 不损害社会公共利益;
⑺ 与研究机构和研究人员能力相适应;
⑻ 研究结果发布方式和时间合理;
⑼ 遵守科学规范与诚信。伦理委员会进行及时、独立、规范、高效的伦理审查。
项目进行过程中
涉及修正方案的审查,年度/定期跟踪审查,安全性报告/严重不良事件(SAE)审查,不依从/违背方案审查等等广义的跟踪审查类型。
如果项目暂停/提前终止,在项目组提出申请报告后,伦理委员会需要评估受试者是否已全部出组、仍在组受试者的相关权益保护措施等方面。如果项目在本中心已完成,课题组需要提交伦理结题报告。伦理委员会通过结题审查,评估研究的风险受益比;受试者的相关权益及保护措施。在伦理审查后签发同意结题的伦理审查意见。
这些是伦理审查在科研项目全过程管理不同环节中所进行的具体工作,也是保护参加临床研究受试者权益的重要内容。
伦理审查的具体流程包括研究者临床研究项目伦理申请材料的送审,伦理委员会办公室对申请材料的形式审查、建档及签收受理,伦理委员会及其办公室对已受理材料的处理、审查,以及伦理委员会伦理审查决定文件的传达,伦理申请材料及审查文件的建档、存档、归档。


5、 医学研究备案
根据《北京市卫生健康委员会关于做好医疗卫生机构临床研究项目备案管理的通知》文件要求,自2020年9月1日起,北京市行政区域内各级各类医疗卫生机构(含中医类、军队系统除外)应将本机构作为承担单位开展的研究者发起、非以产品注册为目的的临床研究项目,均需要在国家医学研究登记备案信息系统(http://114.255.48.20)进行备案。2016年中华人民共和国国家卫生和计划生育委员会颁布的《涉及人的生物医学研究伦理审查办法(第11号)》的“经伦理委员会批准的研究项目在实施前,研究项目负责人应当将该研究项目的主要内容、伦理审查决定在医学研究登记备案信息系统进行登记。”(第25条)、“医疗卫生机构应当在伦理委员会设立之日起3个月内向本机构的执业登记机关备案,并在医学研究登记备案信息系统登记。医疗卫生机构还应当于每年3月31日前向备案的执业登记机关提交上一年度伦理委员会工作报告。”(第14条)。因此,作为承担临床研究项目的研究者,需要关注伦理审查的要求提交伦理审查申请材料,经伦理委员会批准后,在研究项目实施前,按照医学研究登记备案信息系统(网址:http://114.255.48.20/login)的具体,进行登记备案。
6、结 语
在临床研究过程中,研究者需要确保临床研究项目的科学性及伦理的合规性,时刻评估研究的风险与受益比,严格全程的质量管理,加强对受试者的保护。伦理委员会通过研究项目的初始审查和后期持续跟踪审查,监管临床研究各环节的不同要素,全方位、多角度的保护参加临床试验的受试者权益,成为受试者保护体系整体建设的重要环节。
我们越来越重视伦理学评估,这是科研的正确轨道,也希望这不再是形式上的过场,而是实在的一个科研步骤,并得到所有研究者的充分重视。医学伦理学特别重要,各国都已经出台专门的指南或要求。绝大多数科研是需要伦理学考虑的,一般来说只要是涉及到人,无论整体还是部分,无论是人群还是个体,无论是直接还是间接,无论是观察还是干预,在所有涉及到医学和生命科学的研究活动中,就需要伦理学评估。规范的伦理学考虑既是保护研究对象,也是保证科研活动的公正、道德和合理。我国的科研活动发展越来越多,越来越深入,对伦理学的考虑也要正规化。
——杨辉《中国全科医学》杂志主编
本站所有文章、数据、图片均来自互联网,一切版权均归源网站或源作者所有。
如果侵犯了你的权益请来信告知我们删除。邮箱:dacesmiling@qq.com






