西药研发的一期临床二期临床三期临床一般会有多少人试药?
题主这个问题问的非常好,作为临床试验中数据与统计相关人员,我们经常被申办方问到的就是这个问题:“我这个试验到底要有多少个人来参加?”
换成专业术语来说,就是问这个试验样本量到底要多少?
郑重说明,本文原创,仅为科普性质,要是有大佬来打脸请轻轻打,转载请经我同意,否则收费千元/百字。
————简要回答版————
按照楼上的回答
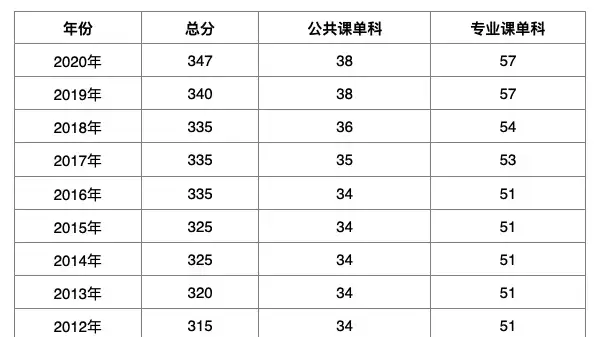
一期20-100
二期100-300
三期300-3000这个答案我猜测出自药品注册管理法,但是请注意,大致的原文(因为懒,没有查找最新的注册法要求)是:
第二十七条: 药物临床研究的受试例数应当根据临床研究的目的,符合相关统计学的要求和本办法所规定的最低临床研……就是说实际人数上边规定的是底线,如果因为统计学要求,样本量可能比这个多。
————很长看着玩版————
为啥要大样本?因为样本量足够大才能有统计学意义,比如 A、B两组人,平均疗效分别是70%、75%,我怎么知道这差别是不是因为一些误差、干扰因素(偏倚)产生的呢?
比如A、B组各20人,疗效分别是70%、75%,和A、B组各300人,疗效分别是70%、75%哪个更有说服力?
题主问的:“大样本”究竟达到什么规模才算大,至少要满足:
1 满足法规规定的人数底线(孤儿药情况后续讨论);
2 样本量必须能满足统计学要求;
1就不说了,法规规定的(当然也有例外);2 统计学要求指什么呢?根据一些统计参数,比如 第一类错误(假阳性)设为α=0.05,把握度1-β设为80%,按设定的检验方法(单侧检验、双单侧检验、秩和检验等等),计算得出样本量至少是n时,才能在统计学上显著(p<0.05);
这是极简描述,请补充统计学背景知识,如假设检验、第一类错误、第二类错误、双单侧检验等等。比如统计师算完之后,这个III期试验样本量应该至少为260人,ok,跟法规一比,至少为300人,那我这个试验取300人,这就算大样本(样本量足够)。
临床试验里统计师有一个超级重要的职责就是算样本量,别看人家就用软件算算,但是试验成败密切相关,比如早年间有些药企不重视统计学,实验都做完了,一算结果,统计学不显著(无统计学意义)P>0.05,药品评审照样不能通过。
样本量相关影响因素
1 成本
一个试验受试者又要做这么多检查、又要吃试验药(比如肿瘤药有多贵大家都知道)、还要报销路费营养费,这全都是要药企出钱,一个人光成本几万几十万都能花出去,药企当然想人数越少越好,省钱啊。
2 伦理学考虑
要是有人说,我不懂统计学,雇一个统计师太贵了(生物统计师薪资有多高,去招聘网站看看就知道了),但是我有钱多找受试者参加我发起的试验!这时候伦理委员会分分钟跳出来拍死你(就是医院里的这个部门根本不批准你的试验申请),理由是:试验药药效不明、还未经过验证(当然了,要不还做什么实验),申办方把这么多人暴露在这个风险下,是违背伦理学考虑的(风险>收益)。
另外碎碎念:国内的伦理审查私认为处于起步阶段,还有很大的发展空间;
3试验设计和药物本身的特点
我只是感性的给大家举例描述,以抗生素为例,抗生素A是经典用药,灭菌疗效70%,抗生素B是新研发的产品,我要证明B药比A药优效(优效性试验),I期、II期试验初步看来,大概(用“大概”形容,是因为前期试验人太少了)的疗效是
情况A:90% 情况B:72%,你猜哪个情况样本量大?
肯定是B,为了证明这2%的差距,而且还要有统计学意义(不是误差、不是混杂因素导致、降低偏倚),人数肯定要比情况A多多多多了。
最后填个坑:孤儿药样本量;
孤儿药指的是治疗罕见病的药物,美国的FDA明确这个概念很多年了,中国的CFDA(貌似改名叫NMPA了,被业内戏称为你x批啊)最近才开始认定罕见病;治疗这种病的药物在计算样本量时候发现:WTF?样本量这么大?我把全世界的病人都加起来也不够啊,比如某个病全世界就2、300个病人,计算之后发现样本量要240人……,这时候药审部门会放宽一些条件,人数不够?没关系,少一点人实验结果我们也承认;
以上~
本站所有文章、数据、图片均来自互联网,一切版权均归源网站或源作者所有。
如果侵犯了你的权益请来信告知我们删除。邮箱:dacesmiling@qq.com
上一篇:了解一下1期临床试验