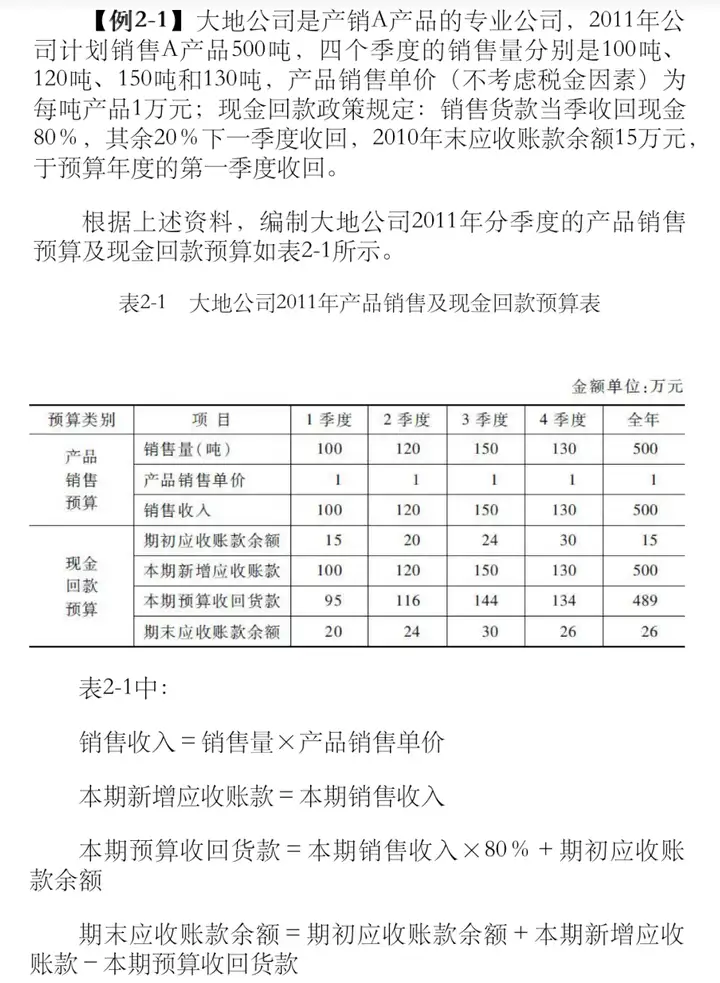
天士力医药集团股份有限公司关于T89预防及治疗急性高原反应申请美国新药上市临床试验进展情况暨风险提示公告
本公司董事会及全体董事保证本公告内容不存在任何虚假记载、误导性陈述或者重大遗漏,并对其内容的真实性、准确性和完整性承担个别及连带责任。
天士力医药集团股份有限公司(以下简称“天士力”、“公司”)T89(复方丹参滴丸,美国FDA临床研究申报代码为T89)预防及治疗急性高原反应(Acute mountain sickness,简称“AMS”)申请美国FDA(美国食品药品监督管理局)新药上市项目(以下简称“该项目”)Ⅲ期临床试验已于近日完成临床试验准备工作,开始受试者入组,进入Ⅲ期临床试验。
一、药物基本信息及研发情况
T89关于急性高原反应(AMS)的预防及治疗是在多个真实世界临床应用观察中发现的新适应症。基于已完成的试验代码为T89-07-CAESA的Ⅲ期临床研究的安全性结果,美国FDA于2018年许可该项目直接进入Ⅱ期临床试验,Ⅱ期临床试验已于2020年完成。公司于近日已完成预防及治疗急性高原反应(AMS)相关Ⅲ期临床试验准备工作,开始受试者入组,正式开展Ⅲ期临床试验。截至2021年6月30日,公司关于T89预防及治疗急性高原反应(AMS)国际临床研究项目的累计研发投入为3905.39万元人民币。
复方丹参滴丸是由公司独家开发研制的一种主要用于预防和治疗心血管疾病的现代创新复方中药,该产品于1998年以药品身份正式通过美国FDA的第一次临床研究(IND)申请,并于2006年再次获得美国FDA的IND批准,确定了预防和治疗慢性稳定性心绞痛(CSA)的临床适应症,并已完成试验代码为T89-07-CAESA的Ⅲ期临床研究。为满足美国FDA对T89治疗慢性稳定性心绞痛(CSA)适应症的药政审批要求,公司正在开展一个多中心、双盲、随机对照的临床验证性研究(试验代码为T89-08-ORESA),详见公司《关于复方丹参滴丸美国FDA新药申报可行性会议情况的公告》(公告编号:临2017-047号),目前此项验证性研究正在进行中。
二、市场情况
急性高原反应(AMS)是一种高原特有的缺氧性常见疾病,在人体急进高原暴露低氧环境后产生的病理生理学变化和机能紊乱并出现相应的头晕、头痛、恶心、呕吐等临床症状,其发病急、进程快。随着登山运动、高原旅游业及经济建设的迅速发展,其用药群体不断增大。针对急性高原反应的不良症状,若未采取预防或治疗措施,可引起高原肺水肿(HAPE)和高原脑水肿(HACE)。根据公开文献显示,在海拔1850米到2750米时,急性高原反应的发生率为25%,在3000米时的发生率为42%。目前,美国FDA批准的针对这一适应症的药物只有乙酰唑胺(利尿降压药),国内外尚未有适应症明确是急性高原反应的天然药物上市。
三、相关风险提示
T89预防及治疗急性高原反应(AMS)申请美国FDA新药上市项目正式进入Ⅲ期临床试验,对公司近期经营业绩不会产生重大影响。
根据美国相关新药研发的法规要求,新药需开展一系列临床研究并经相关药品审评部门审批通过后方可上市。T89为全球首款在美国申请新药上市的复方中药,其临床试验及研究工作具有众多前沿性和原创性,是一个长期系统工程,易受到技术、审批、政策等多方面因素的影响。该项目在美国进行新药申报在药政评审决策、相关研发进展及结果、未来产品上市以及上市后市场竞争形势等方面均存在诸多不确定性。
公司将对该药品在美国申请新药上市的后续进展情况及时履行信息披露义务,敬请广大投资者谨慎决策,注意投资风险。
特此公告。
天士力医药集团股份有限公司董事会
2021年7月23日
本站所有文章、数据、图片均来自互联网,一切版权均归源网站或源作者所有。
如果侵犯了你的权益请来信告知我们删除。邮箱:dacesmiling@qq.com