什么是I期临床试验?
剂量爬坡设计可分为3类:基于规则,基于模型和模型辅助的设计。
肿瘤新药爬坡设计应摒弃传统3+3,基于规则可选i3+3;模型辅助可选择BOIN、mTPI-2;基于模型的设计操作复杂,需慎重选择。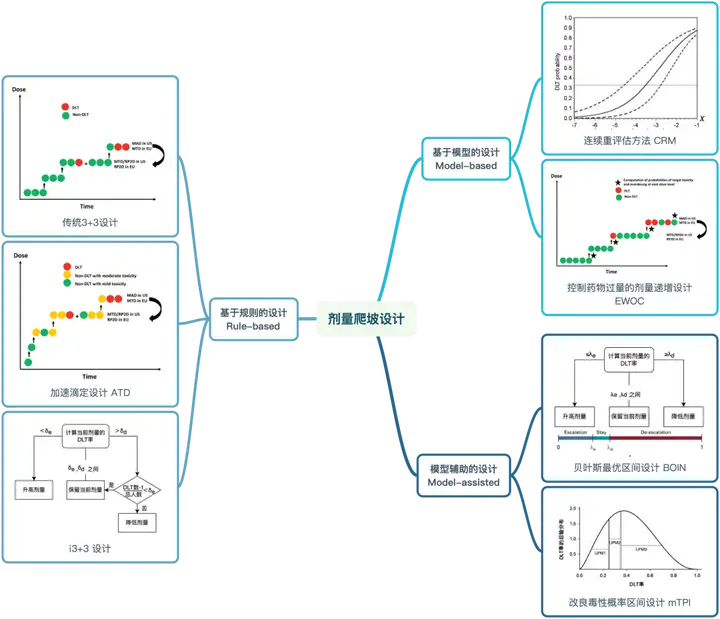
1 剂量爬坡试验与设计类型
1.1剂量爬坡试验
I期临床是新药在人体的首次使用,研究内容之一就包括人体的初始安全性和耐受性评估,以为后续临床试验探索推荐剂量和给药方案。
一般来说,随着剂量升高,疗效和毒性也随之增加。剂量爬坡试验(dose escalation study),便是通过在起始剂量到最大剂量之间,一系列包括升降或保留剂量的序贯决策过程,以找到最大耐受剂量(maximum tolerated dose, MTD)。
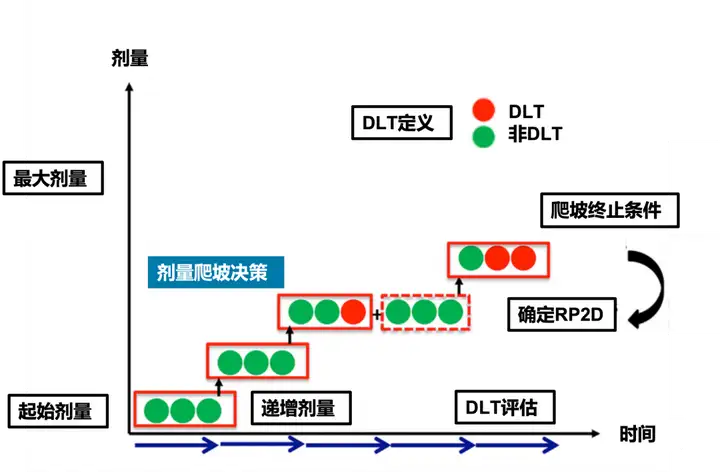
剂量爬坡试验要素:包括起始剂量的选择,最大剂量的确定、递增剂量的选择、剂量爬坡决策、爬坡终止条件、DLT定义与评估、目标毒性概率的确定等等。
今天介绍的是其中剂量爬坡决策的代表方法,适用于肿瘤新药经典单药观察DLT的剂量探索。
1.2 爬坡设计的因素与分类
剂量爬坡方法的两大原则:
通过有限的样本量,尽可能准确地找到MTD;控制在MTD以下(疗效不足)以及MTD以上(超过耐受性)接受治疗的患者数量评价爬坡设计的三个因素:
决策透明及执行简便;调整的灵活性;统计性能表现剂量爬坡方法的分类:
依据是否对剂量-毒性关系预先作出假设,可将剂量爬坡方法分为非参数设计及参数设计。
非参数设计:不预先估计剂量-毒性关系,是基于规则的设计。参数设计:预先建立剂量-毒性关系模型,并根据入组过程中的数据更新模型,决定后续患者接受的剂量。依据模型的复杂程度,可以分为基于模型和模型辅助设计。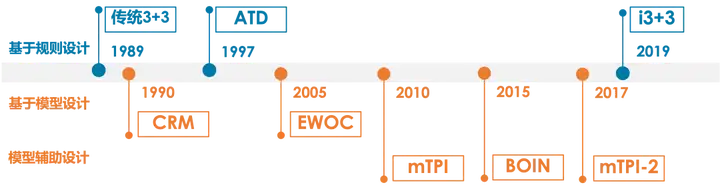
1 基于规则的设计(Rule-based design)
基于规则的设计不预先估计剂量-毒性关系,又称或基于算法的设计(Algorithm-based design)。特点:实施简便透明,应用广泛,接受度高。但缺点是缺乏灵活性,统计性能一般。包括以传统3+3设计为代表的普通A+B设计,加速滴定设计,新发展的i3+3,还有其他各种拓展变形,如PGDE就结合了药理学方法。2 基于模型的设计(Model-based design)
基于模型的设计利用实时数据修订模型。特点:具有较好的统计学性能,但决策不够透明,实施复杂,需统计师跟随试验实时修正,因此使用相对有限。主要的方法包括CRM,EWOC,BLRM等。3 模型辅助设计(Model-assisted design)
模型辅助的设计结合规则的易用与模型的性能。特点:在统计模型估计的基础上制定规则,保留统计性能的同时,有更好的易用性。代表的设计方法,包括BOIN,mTPI和mTP-2。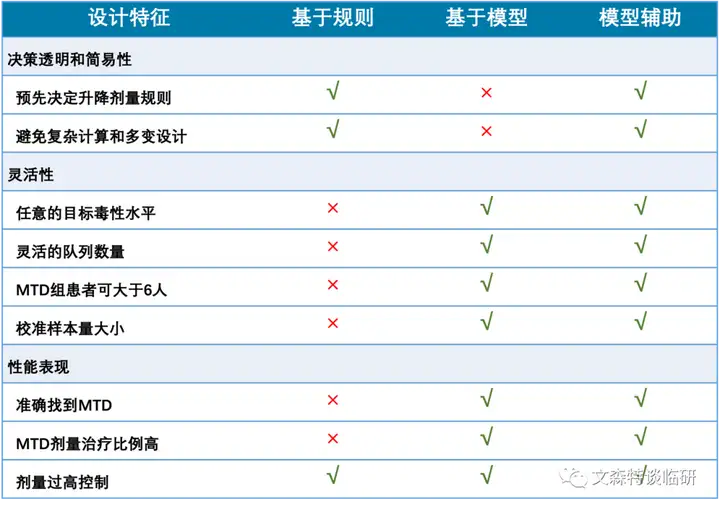
2 基于规则的设计
2.1 传统3+3设计
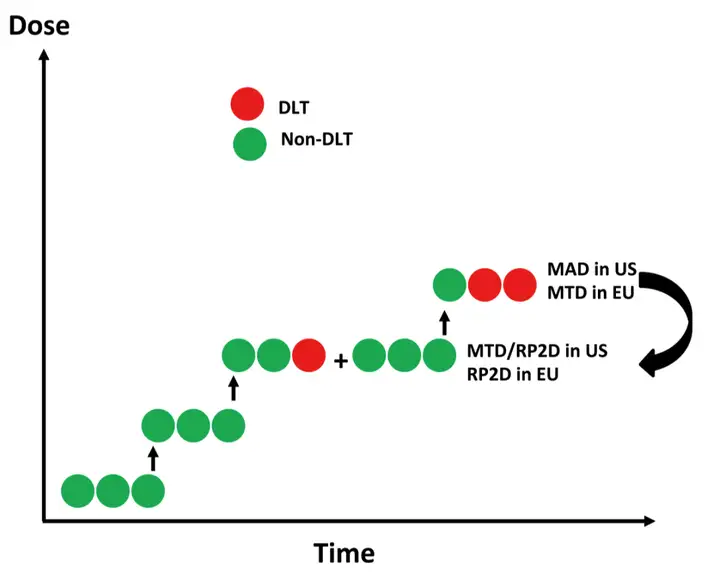
普通A+B设计,依据设定规则增加评估患者。最具代表性的就是传统3+3设计,也是应用最广泛的剂量爬坡设计,其他还有2+4,3+3+3等。
方法介绍:依据DLT人数,0/3递增,≥2/3递减,1/3则增加三人。再依据1/6递增,≥2/6递减;如递减到前一个出现过 DLT的剂量组,由此确定MTD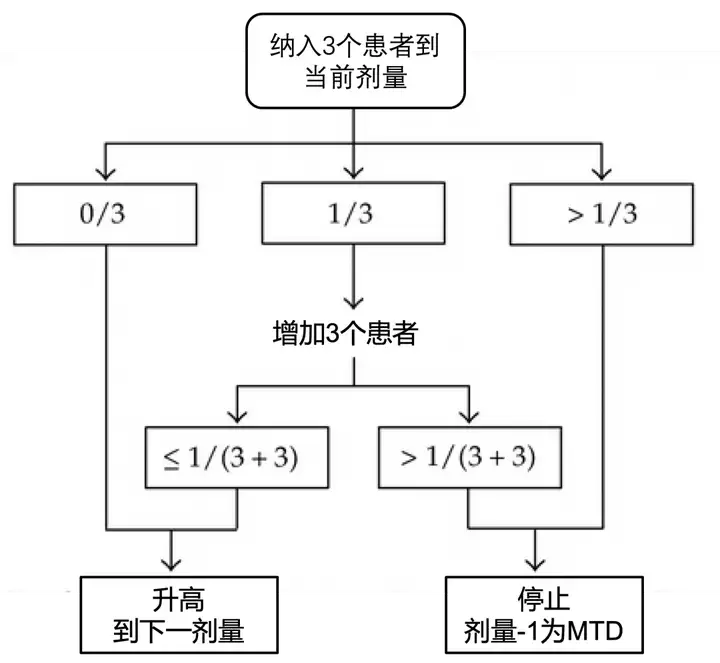
特点:较为直观、执行简便,既往应用广泛,接受度高。
传统3+3设计的问题:
缺少灵活性:目标毒性概率固定为33.3%。伦理及效率:较多患者暴露在有效剂量以下, 同时耗时较长。统计性能一般:MTD剂量接受治疗的患者最多6个,导致较大的变异性。事实上,包括监管和工业届统计专家在内,认为肿瘤精准治疗时代,应该摒弃传统3+3设计,使用更有效的方法来探索剂量。
2.2 加速滴定设计 ATD
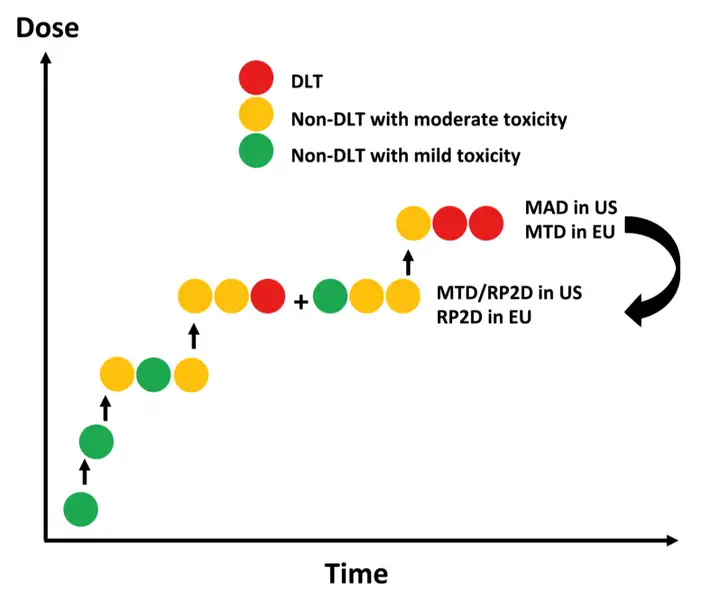
加速滴定设计(accelerated titration design,ATD)
方法介绍:在传统3+3设计基础上的改进。减少了无效剂量的患者暴露,允许对同一受试者进行剂量递增,结合了剂量毒性模型分析毒性差异和累积毒性。特点:快速的初始剂量递增, 提高了效率。
问题:同一患者的剂量递增会部分掩盖较小剂量的治疗效应。同时如药物考虑存在迟发毒性,也不适用加速滴定设计。
2.3 i3+3设计
规则设计的统计性能就都不好吗?芝加哥大学的嵇元教授等于2019年提出了i3+3 (interval 3+3) 的方法,保留了基于规则设计的简便透明特点的同时,获得了良好的统计性能。
方法介绍:基于设定的目标毒性概率与等效区间,可获得升降剂量的区间。将实际DLT率与区间界限比较,便可获得以下剂量决策:DLT率小于区间下限则升高剂量;位于区间内则保留当前剂量;
如DLT率大于区间上限,同时DLT数-1/样本量小于下限,则保留当前剂量;DLT数-1/样本量未小于下限,则降低剂量;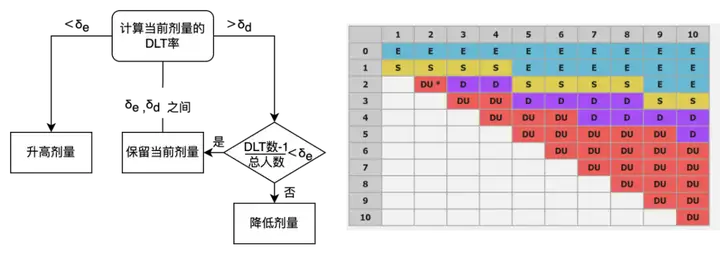
i3+3设计同时也给出了决策表,可以方便使用者判断当前的剂量选择。一经问世,i3+3设计已开始得到应用。
3 基于模型的设计
不同于基于规则的设计仅依据事先设定的规则,基于模型的设计,则充分利用了试验过程中的信息,指导后续的剂量选择。
3.1 连续重评估方法 CRM
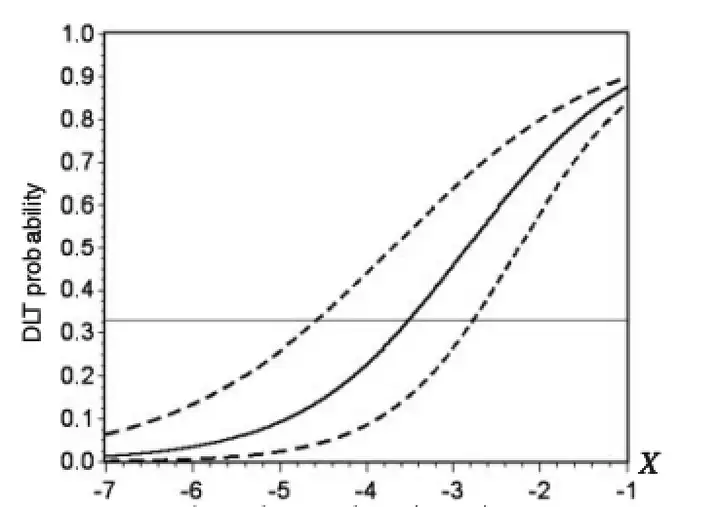
连续重评估方法 (continual reassessment method, CRM)
方法介绍:依据临床前结果推断剂量毒性曲线模型,并根据新接受治疗患者的数据更新模型,以此指导下一组患者接受的剂量,直到得到的剂量不再变化或达到样本量。依据更新后曲线的变化,就可得出目标毒性对应的剂量。特点:充分利用了已知信息,从连续剂量分布中推断MTD。
问题:设计复杂,需统计师实时调整模型,决策不透明;同时可能因剂量递增过快而出现剂量过高(overdose)的问题。
3.2 控制药物过量的剂量递增设计 EWOC
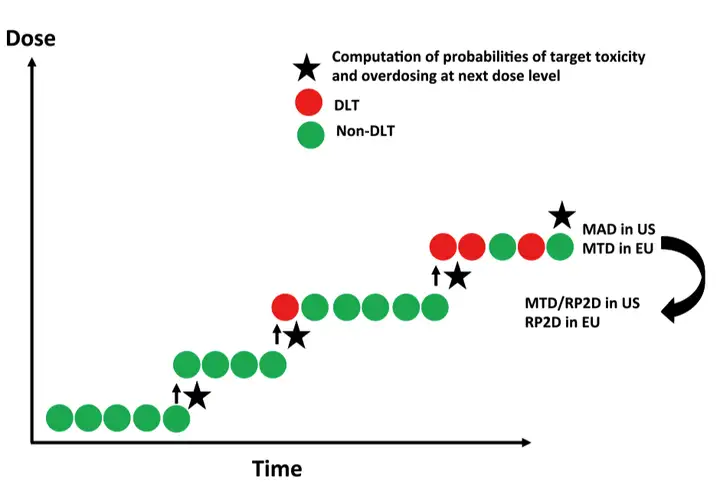
控制药物过量的剂量递增设计(escalation with overdose control, EWOC)
方法介绍:EWOC同样是在当前患者的信息上推断下一个患者的剂量。顾名思义,EWOC是在CRM基础上控制剂量过高的改良。特点:相比CRM,EWOC加入了推断下一例患者剂量过高的风险,如超过最大风险(如大于25%),则药物剂量不再递增。
问题:实施过程复杂。
以上两种方法以外,基于模型的设计类型不止于此,还可以结合毒性发生时间、结合疗效终点设计等。
总体来说,基于模型的设计统计性能较好,应用贝叶斯统计提供了新的视角,但由于其依赖先验模型及操作复杂,在其推出30年以来应用不广。
4 模型辅助的设计
有没有即具有统计学效能,又决策透明、易于实施的剂量爬坡方法呢?下面介绍的模型辅助的设计,可以回答这个问题。
4.1 贝叶斯最优区间设计 BOIN
贝叶斯最优区间设计 (Bayesian optimal interval design,BOIN), 即波音设计,由MD Anderson癌症中心的袁鹰教授于2015 年提出。
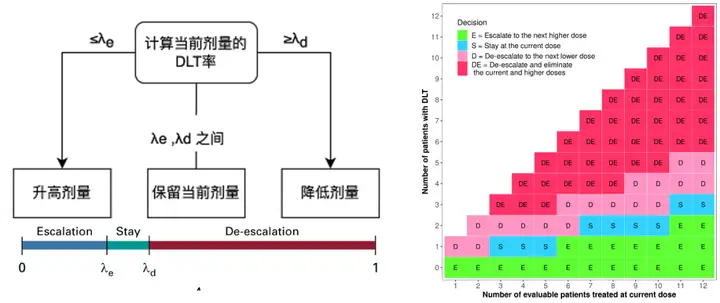
特点:获得优越性能的同时,决策流程透明,可结合决策表,灵活易用。
目前,BOIN设计已被工业和监管广泛接受应用于I期剂量爬坡试验,包括得到了FDA的官方认证。
4.2 改良的毒性概率区间设计 mTPI
无独有偶,模型辅助的设计的代表方法,还有嵇元教授于2010年提出的改良的毒性概率区间设计(Modified toxicity probability interval design,mTPI) 以及2017年更新的mTPI-2。
方法介绍:mTPI依据临床与统计确定的目标MTD和等效区间,定义3个剂量毒性区间:过低、适当和过高区间,通过计算3个区间的单位概率质量UPM来决定剂量增减。
mTPI同样可依据毒性概率区间的决策表简化操作,而不需要实时重复计算mTPI-2对mTPI的修正
mTPI中在样本量较小时,可能出现剂量过高的风险, 如接受2/4,3/6的DLT继续保留剂量。因此,2017年提出了mTPI-2设计,对此进行了修正,钝化了“奥卡姆剃刀”。
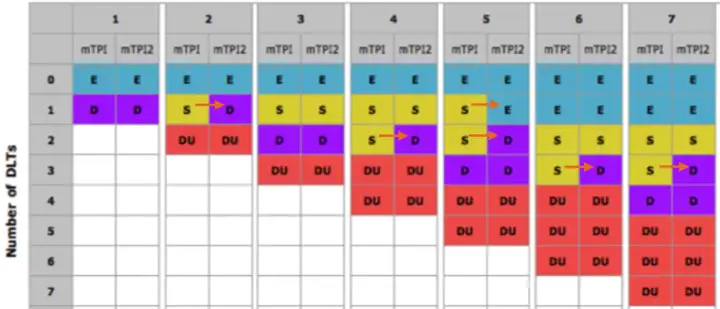
目前mTPI-2的使用较为广泛,已在大量临床试验中证明了其统计性能。
5 总结
今天介绍了抗肿瘤新药剂量爬坡试验中的一个要素:剂量爬坡决策。
1.爬坡设计方法分三类,分别是基于规则的设计,代表有传统3+3,ATD和i3+3设计;基于模型的设计,有CRM和EWOC;模型辅助的设计,介绍了BOIN,mTPI和mTPI-2。
2. 爬坡设计建议摒弃传统3+3, 基于规则可选i3+3,模型辅助可选BOIN,mTPI-2等,保留优越性能的同时又灵活易用。基于模型的设计,由于操作复杂应慎重选择。
剂量爬坡设计的方法远不于此,如毒性结合有效性终点探索最佳生物剂量(optimal biological dose,OBD),有EffTox,UBOIN设计等。与此同时,结合爬坡的其他要素,如最大剂量,联合爬坡等,也引出新的问题。
希望借此,能带来对剂量爬坡设计多一些了解。设计过程中,需要临床、药理与统计团队,与研究者和监管充分的沟通,以确保爬坡设计的高效与合理。
参考文献:
Kurzrock, R. et al. American Society of Clinical Oncology Educational Book e133–e144 (2021)Yuan, Y., Lee, J. J. & Hilsenbeck, S. G. JCO Precision Oncology 1–12 (2019)Zhou, H., Yuan, Y. & Nie, L. Clin Cancer Res 24, 4357–4364 (2018).Liu, M., Wang, S.-J. & Ji, Y. Journal of Biopharmaceutical Statistics 30, 294–304 (2020).Zhou, Y., Li, R., Yan, F., Lee, J. J. & Yuan, Y. Statistics in Biopharmaceutical Research 13, 147–155 (2021).Ji, Y. & Wang, S.-J. JCO 31, 1785–1791 (2013).Guo, W., Wang, S.-J., Yang, S., Lin, S. & Ji, Y. [stat] (2016).Hansen, A. R., Graham, D. M., Pond, G. R. & Siu, L. L. Cancer Control 21, 200–208 (2014).Morita, S. Statist. Med. 30, 2090–2097 (2011).Cook, N., Hansen, A. R., Siu, L. L. & Abdul Razak, A. R. Molecular Oncology 9, 997–1007 (2015).Nie, L. et al. Clin Cancer Res 22, 2623–2629 (2016).van Brummelen, E. M. J., Huitema, A. D. R., van Werkhoven, E., Beijnen, J. H. & Schellens, J. H. M. Pharmacokinet Pharmacodyn 43, 235–242 (2016).CRP聊新药研发与临床试验,关注专栏/公众号:文森特谈临研
本站所有文章、数据、图片均来自互联网,一切版权均归源网站或源作者所有。
如果侵犯了你的权益请来信告知我们删除。邮箱:dacesmiling@qq.com
上一篇:医克生物于深圳启动临床一期试验
下一篇:关于1期临床试验的几个问题






