医学发表-ClinicalTrials.gov临床注册流程
目前,很多专家和学者都热衷于临床试验研究,出于伦理和科学的研究,一项临床试验在实施前需要在公开数据库上进行注册,并跟踪和报告试验结果。临床试验注册制度已成为当前临床试验发展的主流趋势。然而,很多研究者对于如何完成临床试验注册并不了解,本文以美国http://ClinicalTrials.gov为例,和大家分享下如何进行临床试验注册。
为什么要进行临床注册?
1)开展临床试验注册的目的主要是出于伦理和科学的要求,试验注册可确保追踪到所有试验的结果,通过深入了解试验的过程和结果,可有助于降低偏倚风险。
2)开放获取正在进行或已完成的试验的信息既符合保护受试者的伦理责任,也进一步提升工作对临床研究的信任。
3)对于受试对象而言,他们也希望对医学领域的贡献用来改善人群的卫生保健质量。
什么样的临床研究需要注册?
所有在人体中和采用取自人体的标本进行的研究,包括各种干预措施的疗效和安全性的有对照或无对照试验(如随机对照试验、病例-对照研究、队列研究及非对照研究)、预后研究、病因学研究、和包括各种诊断技术、试剂、设备的诊断性试验,均需注册并公告。
临床试验注册平台简介
目前,国际上临床试验注册平台有很多,包括: 世界卫生组织国际临床试验注册平台(WHO ICTRP,有多个一级注册机构),英国国立研究注册库(BNNR),澳大利亚临床试验注册库(ACTR),英国当前对照试验注册库(CCT),美国临床试验注册库(http://ClinicalTrials.gov);中国也有自己的临床试验注册中心(ChiCTR)。为了避免利益冲突,提高公众的信任度,临床试验注册库的创建和管理应符合一定的要求。国际医学杂志编辑委员会(ICMJE)对临床试验注册库提出了一定的标准,详见图1。http://ClinicalTrials.gov由于注册流程简便,符合ICMJE标准,是当前最具国际影响力的临床试验注册机构之一,应用最为广泛。
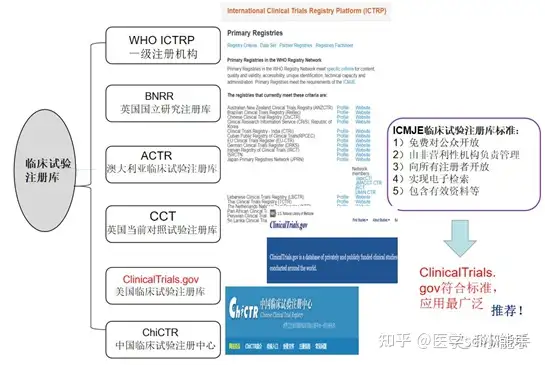
图1. 国际临床试验注册机构/平台及ICMJE标准
ClinicalTrials. gov主要优势有以下几点:
1)注册流程简洁快速
2)信息单元严谨巧妙
3)操作界面清晰友好
4)开放的临床试验资料库
5)良好的内在质控系统
ClinicalTrials. gov简介
ClinicalTrials. gov于1997年由美国国家医学图书馆(NML)和美国食品与药物管理局(FDA)共同创办,内容涉及各种疾病及其症状。2004年后,开始对国际上临床试验进行开放。http://ClinicalTrials.gov符合ICMJE要求,被列为公开化,国际化临床试验注册的典范。其官网链接: https://clinicaltrials.gov/。
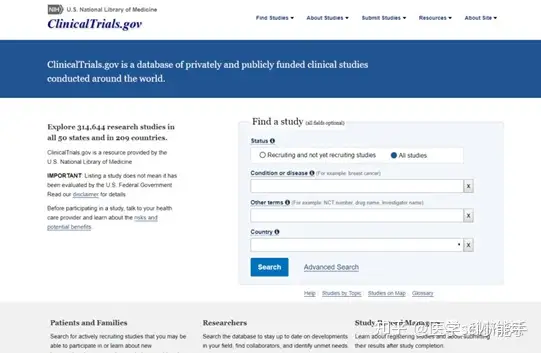
PRS账户申请
在进行注册之前,首先申请研究方案注册系统(Protocol Registration System, PRS)账号。PRS账号分为两种,一种是 单位账号(如:公司,高校或医疗机构等),可用于一个机构进行多个临床试验注册。申请网址链接:https://www.clinicaltrials.gov/ct2/apply-account-org。另外一种是申请个人账号(不推荐),注册链接为:https://www.clinicaltrials.gov/ct2/apply-account-individ? indivAccount=true。在申请后的两个工作日内,生成账号并通过电子邮件形式告知申请者如何登录和注册临床试验。
临床试验方案信息单元填写
在完成PRS账号申请后,打开 http://ClincialTrial.gov登录界面后,如图2所示,在输入单位信息(Organization), 用户名和密码后,进入临床试验注册界面。建议初学者严格按照流程,一步一步认真填写http://ClincialTrial.gov中研究方案的信息,需要填写的内容涵盖了临床试验的方方面面,主要包括研究方案和背景资料,受试者评审信息和FDA相关的12个方面内容,见图。http://ClinicalTrial.gov上填写信息均为英文,带有“*”号的为必填项。
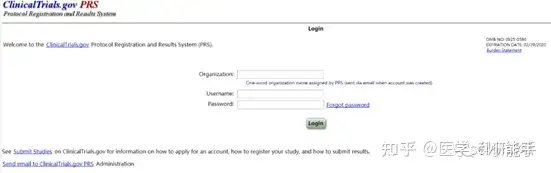
图2 .http://ClincialTrial.gov用户登录界面

接下来,本文针对临床试验方案注册需要填写的12个模块内容,逐一进行阐述。
1. Study Identification
Organizations UniqueProtocol ID:临床研究设计方案唯一识别号
Title:研究方案的题目
Type:研究设计的类型,包括干预性研究,观察性研究和拓展性应用3个选项。
2. Study Status
Record Verification Date:试验的核查日期,即最近一次核查试验方案的日期。
Overall Recruitment status:招募状况
Study Start date:研究开始日期
Primary/ Study completion Date:初步/ 研究完成日期
3. Sponsor/Collaborators
填写临床试验的责任方,主办方和合作者三方面的相关信息。
4. Oversight
对于临床试验研究,如为FDA 注册的规范化干预,则需进一步填写是否为801 款临床试验和是否延迟公开登记信息。如果研究有经FDA 批准的临床试用新药申请或临床器械研究豁免(Investigational Device Exemption, IDE),则必须填写IND/IDE 序列号,以及该序列号的颁发部门等。
5. Deion
对临床研究设计的方案进行概括,填写在Brief Summary中。摘要(必填项)。包括对试验假说的简要阐述(5000字符)。
6. Conditions
研究方案的对象或研究重点,即研究关注的疾病或健康状况。
7. Study Design
根据研究设计的不同进行填写,若为干预性研究,需填研究目的(Primary Purpose), 研究阶段(Study Phase), 干预模型(Intervention Model), 分组数(Number of Arms), 盲法(Masking), 干预分组方式(Allocation),受试对象数目(Enrollment), 研究终点(Study Classification)等方面试验内容。如果为观察性研究,则需填写模型种类(Observational Study model), 观察时间点(Time Perspective), 生物标本存放形式(Biospecimen Retention), 受试者数目和分组数目(Number of Groups/Cohort)等内容。
8. Arms and Interventions
填写试验分组的名称和类型,若为干预性研究,需要特别填写干预类型(Intervention Type)和名称(Intervention Name),并进一步详细说明。
9. Outcome Measures
对于试验的研究结局进行描述
10. Eligibility
该部分主要包括研究人群( Study Population Deion), 抽样方法( Sampling Method),性别,年龄,纳入和排除标准(Eligibility criteria) 和是否接受健康志愿者(accept healthy volunteers)
11. Contact/Locations
该部分主要填写试验各中心的名称(Name),地址(City, State/Province, Country)和人群招募情况(RecruitmentStatus)。同时填写研究者的相关信息等
12. References
填写研究方案的参考文献(References)和相关网络链接。参考文献需要提供PMID号或文献标引,若为网站,需提供准确的网址,并做说明。
在完成所有单元信息的填写好,点击提交,专业审查人员将研究方案进行审查,审查合格后,对通过的临床注册方案进行公开,系统里状态更新为Public,概括以下,整个ClinicalTrials. gov注册流程见图3。值得注意的是,随着临床试验的进展,研究者需要对相关信息内容及时进行更新,直至完成注册,获取NCT号。
图3. ClinicalTrials. gov注册流程
NCT账号查询
ClinicalTrials. gov是一个开放的临床试验资料库,研究者可以在上面查询到已注册的临床研究的相关信息,既有助于加强试验的透明度,也能使研究者及时了解到相关学科领域的临床试验的开展情况,避免和前人的研究重复。本文以2019年8月在JAMA上发表的文章为例,在http://ClinicalTrials.gov上输入注册号,查询该项研究注册的相关信息和进展情况。

本站所有文章、数据、图片均来自互联网,一切版权均归源网站或源作者所有。
如果侵犯了你的权益请来信告知我们删除。邮箱:dacesmiling@qq.com






